2023-02-24
2023年伊始,随着各大药企2022年财报出炉,吉利德的CAR-T产品Yescarta销售额在2022年实现了显著增长,达11.6亿美元,同比增长66.9%,成为了全球首款年销售额超过10亿美元的CAR-T产品。 此外,百时美施贵宝(BMS)和2seventy bio的BCMA CAR-T疗法Abecma的销售额也于近日公布,2022年同比增长136%,销售额达到3.88亿美元。我们欣喜地看到CAR-T作为一种全新疗法,逐渐被大家接受和认可,并且市场潜力巨大。
在感到喜悦的同时,我们也看到,目前已上市的CAR-T疗法在临床应用的可及性依然存在障碍,如吉利德认为产能不足是影响其销售额的重要原因;2seventy bio的首席执行官也表示:“可及性不仅仅是CAR-T定价高的问题,产能也存在一个巨大的瓶颈。”因此,迫切需要一种更可及的治疗产品,改写患者们的未来治疗格局。GA黄金甲生物的非病毒定点整合CAR-T技术(Quikin CART®)采用非病毒方式,临床验证安全有效,有望取代现有的传统CAR-T疗法,成为新一代更可及的CAR-T疗法产品!
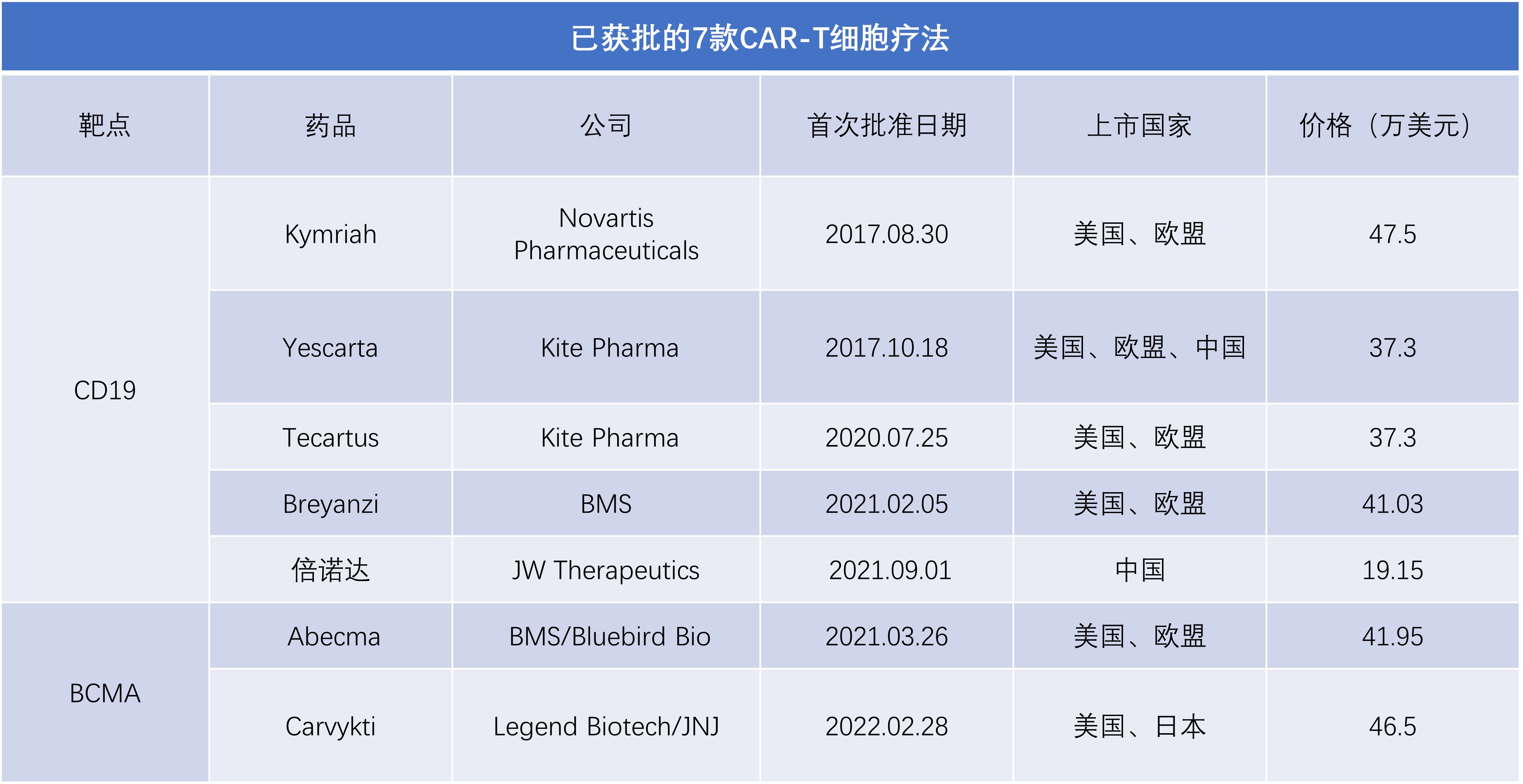
已上市7款CAR-T产品售价
临床阻碍一:制备周期长,产能不足
目前上市的几款CAR-T产品均是通过病毒载体来实现,生产工艺比较复杂,制备时间较长,进而导致产能受限无法满足庞大的患者需求。2022年美国癌症研究所Nature reviews drug discovery文中也提到,在临床应用中,产能不足如病毒载体短缺是导致临床应用的重要障碍,占到1/4以上。吉利德也表示,虽然Yescarta销售额在2022年实现了显著增长,但却处于一种供不应求的状态,他们认为产能不足是影响其销售额的重要原因。因此,迫切需要一种制备周期短,生产工艺简单的CAR-T产品满足更多患者需求。
临床阻碍二:高昂的价格
根据2022年美国癌症研究所(Cancer Research Institute)Samik Upadhaya博士等人在Nature reviews drug discovery发文,通过对真实接受 CAR-T疗法的临床患者分析,发现CAR-T疗法的临床实际应用可能仍存在障碍,一个直观的数据就是CAR-T 细胞疗法在临床实践中的使用已落后于监管部门的批准数量。根据参与调查中心的肿瘤学家说法,成本是让肿瘤患者接受细胞疗法治疗的主要障碍,约65%的肿瘤患者认为CAR-T产品高昂的价格是让其不能接受细胞疗法治疗最主要因素,其次才是是否满足指征(63%)和疾病进展情况(54%)。
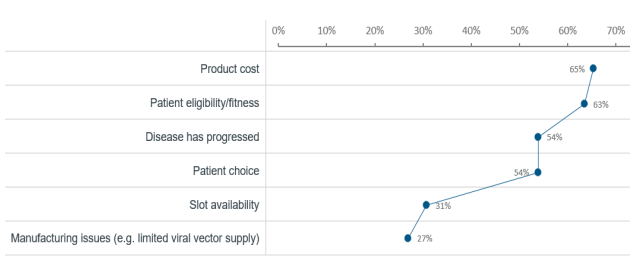
CAR-T临床实际应用中可能存在的障碍
未来趋势,非病毒CAR-T疗法更可及!
CAR-T细胞作为一种活的细胞药物,是一种革命性的、充满希望的免疫细胞疗法,市场空间巨大,但我们也看到,CAR-T疗法在临床应用依然存在障碍,主要原因在于产能不足、制备周期长、价格高昂等。GA黄金甲生物的非病毒定点整合CAR-T技术可以在不使用病毒载体的情况下,将CAR序列定点插入到T细胞基因组的特定位点(PD1位点),一步实现CAR稳定整合和内源基因调控,属于全新一代更可及、且更安全及更有效的CAR-T细胞治疗产品,可完美解决上述病毒CAR-T治疗的痛点,替代现有CAR-T疗法。
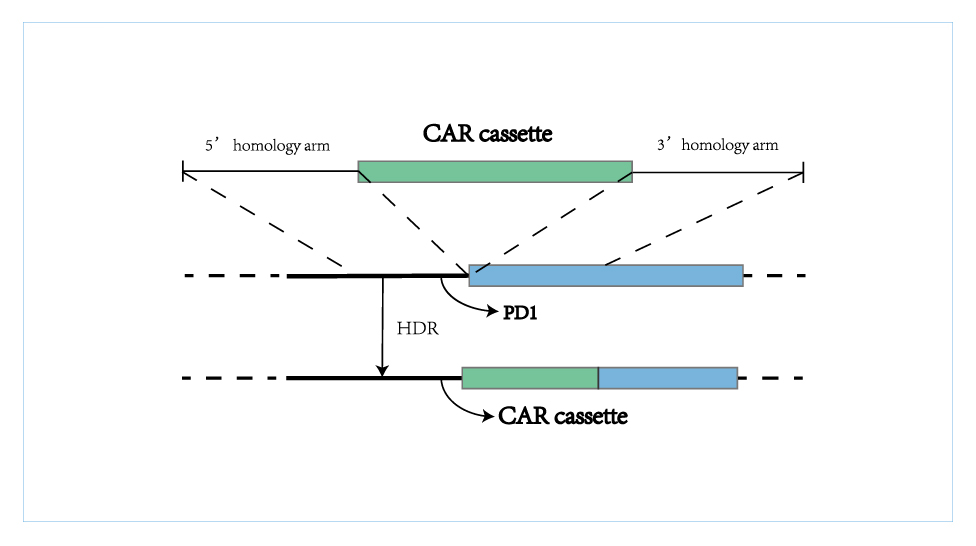
GA黄金甲生物Quikin CART®平台
1. 成本低,可惠及更多患者
BRL-201是GA黄金甲生物利用其具有自主识产权的Quikin CART®平台开发的靶向CD19的CAR-T产品,在不使用病毒载体情况下,利用2020年获诺贝尔奖的CRISPR/Cas9基因编辑技术对T淋巴细胞中PD1位点精确编辑,定点插入针对肿瘤细胞的靶向CD19的CAR分子,使用非病毒生产工艺还可以极大减少因使用病毒载体带来的高昂成本,减少复杂的工艺和生产检测成本,相比中国批准的首款CAR-T产品120-130万元人民币的价格,BRL-201有望成为更惠及病人大众的细胞疗法, 为更多患者带来福音。
2. 制备快,适用进展快的患者
从生产工艺来看,传统CAR-T产品的制备时间都比较长,目前上市的几款CAR-T产品制备时间约为15-28天,这极大增加了患者等待用药的时间,也意味着这样的CAR-T产品无法用于肿瘤进展非常快的患者,并且往往制备周期较长也会导致产能受限,如2022 ASH年会上美国三大癌症中心之一的希望之城负责人在接受媒体采访时表示,当一位多发性骨髓瘤患者在同意接受CAR-T治疗后会进入一份“等候名单”,而这份名单有时会长达六个月。而GA黄金甲生物的BRL-201产品采用非病毒制备方式,工艺简单,只需一步制备,即可同时实现CAR的持续性表达和T细胞内源基因的调控,大大缩短了整个CAR-T的制备时间,最短3天可完成制备,并且同期可以完成多批细胞制备,可极大提高产能,可及时供应于肿瘤进展快的患者。
3. 更安全,保证产品的均一性
由于病毒采用随机插入的方式将CAR序列整合到细胞基因组中,可能会改变正常基因的表达,因此存在潜在的致瘤风险,并且通过这种方式制备获得的CAR-T产品均一性很低;而非病毒定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。在开展的BRL-201治疗复发难治性非霍奇金淋巴瘤临床试验中,8例患者接受治疗后,未观察到CAR-T相关的神经毒性和2级以上细胞因子风暴,证明了BRL-201具有出色的临床安全性。
4. 更有效,打破复发难治枷锁
在接受BRL-201治疗的难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%,证明PD1-19bbz CAR-T细胞具有出色的临床有效性,是迄今为止全球CAR-T细胞治疗难治复发淋巴瘤中高缓解率和低毒副反应的最好临床结果,且患者长期获益显著高于现有病毒产品,mPFS从2.9-12.8个月(现有病毒CAR-T)提高到20个月(GA黄金甲BRL-201 CAR-T)。另外,进一步的单细胞测序结果表明PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的抗肿瘤功能,长期存续的CAR-T细胞具有记忆性细胞的特征。这也全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制。研究论文也于2022年8月31日在国际顶级期刊Nature在线发表,标志着中国学者在CAR-T细胞研发及临床转化应用领域处于国际领先地位。

Quikin CART®成果发表在Nature
Quikin CART®技术作为新一代细胞疗法,具备了现有其他CAR-T技术所没有的诸多优点,有望取代现有CAR-T。GA黄金甲生物希望利用这一全新一代的CAR-T技术,开发出更多安全有效的CAR-T产品,来造福广大患者。同时,随着近年来基因编辑等新兴生物技术的发展,相信今后会有更多先进、强大的技术平台被陆续开发出来,我们在技术迭代上也会努力做出更多突破性的工作,以期为疾病的临床治疗带来更多的希望。
参考资料:
[1] Saez-Ibañez AR, Upadhaya S, Partridge T, Shah M, Correa D, Campbell J. Landscape of cancer cell therapies: trends and real-world data. Nat Rev Drug Discov. 2022 Jun 1. doi: 10.1038/d41573-022-00095-1.
[2] Zhang, J., Hu, Y., Yang, J. et al. Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL. Nature 609, 369–374 (2022). https://doi.org/10.1038/s41586-022-05140-y